袁方舟
作者简介:中国海洋大学食品科学硕士,主要研究方向为食源性致敏原控制。现就职于纽勤中国食品安全部,负责真菌毒素、致敏原、纽勤酶博士(Megazyme)等理化快检产品的应用开发与技术支持工作。
食源性致敏原已日益成为各大食品和饮料制造商的关注焦点。对于企业管理者来说,理想状态自然是用专门的设备来分别生产含致敏原和无致敏原的食品——但在现实情况下,它们往往在相同的设备上生产。
因此,我们需通过可靠的环境监测方案来评估环境中致敏原的存在情况[1]。

致敏原控制的环境监测应包括支持食品安全或HACCP计划确认的采样计划。采样计划的确认包括:采样点的选择、采样频率的确定、样品采集数量、阈值的确定以及纠偏措施。
采样点的选择及采样频率的确定
采样点的选择与ATP检测和微生物指示菌检测的过程类似。
如图1所示,致敏原的检测重点应放在区域1和区域2,即生产线清洁后和投入生产之前对位点进行即时性验证。至于清洁验证,应使用基于风险的方法,既要考虑表面受到污染(危害)时对食品的影响,也要考虑表面正确清洗的难度(概率) 。
难以清洁的直接接触区域(区域1)以及邻近的非直接接触区域(区域2)应优先进行高频率检测;而那些远离食品的区域(区域3和区域4)或非常容易清洁的区域(光滑、平整且容易接触的表面)应优先考虑低频率的检测。
例如,对于高风险区域(图1表格中红色部分),每次清洁时都应进行检测,或者以较高的频率进行检测,比如每周一次;中度风险区域(图1表格中黄色部分)可以以每周一次至每月一次的较低频率进行测试;低风险区域(图1表格中绿色部分)则应以更低的频率进行检测,如每月一次或每季度一次。
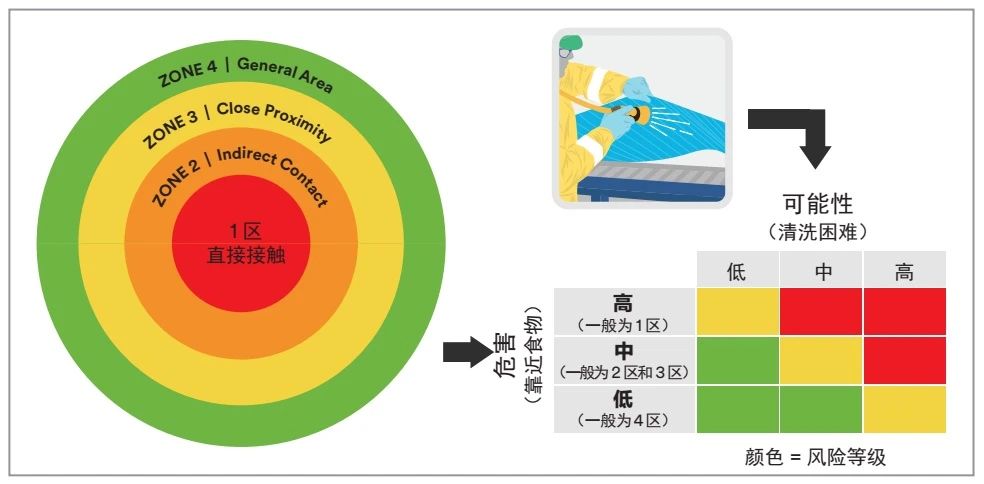
图1 致敏原检测风险区域的识别
样品采集数量
采样数量取决于生产设备或生产线的复杂性和实际的检测预算——一般来说,每条线应设置5到10个检测点以获得足够的覆盖率,从而大大降低未检测到清洁不到位的风险。
当然,确切的数量应由质量团队决定,其合理性应在工厂的食品安全计划或HACCP计划中进行规划和记录。食品企业可以根据风险评估的结果调整检测频率,从而确保他们投入在检测上的资源得到化降低风险的效果。
确定阈值
致敏原阈值的设定一直是客户关注的焦点,但国际上尚未有统一的阈值标准,仅食品法典委员会确定了无麸质食品的阈值为20 mg/kg[2]。
虽然目前对食品致敏原的阈值几乎没有达成共识,但食品致敏原研究和资源项目组(FARRP)认为,若使用ELISA试剂盒作为检测工具,清洁验证通过的结果应低于试剂盒的定量限LOQ(致敏原试剂盒的LOQ一般为2.5-5 ppm (μg/g) ,或大致相当于1.25-2.5 μg/100 cm2,主要取决于方案中采样拭子的提取效果),从而有效减少终端消费者的风险[3]。
尽管监管机构缺乏明确性,但这也是为监测系统设置环境阈值的一种实用方法。
纠偏措施
当样本致敏原检测结果超过所制定的阈值时,基于图1中确定的风险级别,立即采取响应纠偏措施。
高风险区域(红色)出现阳性结果:需重新清洗设备并再次进行检测。
中等风险区域(黄色)出现阳性:可以根据产品类型进行自主判断。理想情况下,应对该区域重新进行清洁,增加对该区域的监测和/或深度清洁。
低风险区域(绿色)若出现阳性结果,应安排在未来的某一日期进行再次清洁,并在清洁流程结束后再次进行检测。
完整的致敏原控制策略还应包括环境监测方案中的根源原因分析(确定致敏原的潜在来源)以及短期和长期纠偏措施。一些典型的纠偏措施包括:
更改清洗频率。
重新确认清洁程序。
改变清洁过程以消除变异性或提高有效性。
对设备进行评估以确定进行升级或更换。
升级工厂设计以改善清洁效果。
加强原材料的隔离。
环境监测方案确认后,日常的致敏原环境控制措施的验证一般有两种方法:
高度特异性的致敏原检测,依赖于特定蛋白质的识别,产生定性或定量结果;
非特异性致敏原检测,通常检测环境中残留的总蛋白质,其存在可能表明清洁过程不充分。当然清洁效果的验证还可以使用ATP检测技术。
致敏原测试方法的选择应基于风险分析,有助于验证采取的措施对致敏原控制是否有效。无论是特异性还是非特异性检测,重要的是对所选的检测方法进行确认,以确保该检测方法符合控制目的且能可靠地检测出样品中的致敏原成分。
- 纽勤产品解决方案 -

纽勤Clean-Trace® ,Reveal® 3-D,Veratox®
致敏原快速检测产品
产品介绍
纽勤提供全面的食物致敏原检测试剂,可检测原材料,CIP清洗水、成品和环境表⾯上的⽬标致敏原。纽勤的致敏原产品能帮助您筛查进料、隔离含致敏原的材料,并对您工厂的清洁计划进⾏验证和确认。
应用领域
食品致敏原快检
往期回顾
参考文献
